SINOPHARM. La vacuna del laboratorio chino ya ha sido aplicada a más de 400 mil profesionales de la salud.
Actualización: 10 de marzo de 2021 - 9:00 a.m.
El último viernes se difundió un informe preliminar del ensayo clínico de la vacuna contra la Covid-19 del laboratorio chino Sinopharm, que se desarrolla en nuestro país. Ernesto Bustamante, actual candidato al Congreso por Fuerza Popular y vocero de este partido en temas de salud, presentó la información. ¿Qué nos dicen realmente estos datos y cuál es la manera más correcta de interpretarlos, desde la evidencia científica?
En este artículo explicamos algunos de los temas discutidos y los términos vinculados a los ensayos clínicos que han causado confusión durante los últimos días, y son esenciales para interpretar la información de manera prudente y correcta.
¿Qué entendemos por eficacia?
Dos términos asociados al desarrollo de las vacunas contra la Covid-19 son eficacia y efectividad. Aunque están vinculados, no deben usarse como sinónimos debido a que representan conceptos distintos: por un lado, la eficacia está asociada al efecto de la vacuna en un contexto de ensayos clínicos; mientras la efectividad hace referencia a la protección del antígeno en condiciones reales.
Edward Mezones-Holguín, médico epidemiólogo e investigador explica que el porcentaje de eficacia se mide en estudios clínicos de fase III (como el realizado por Sinopharm en Perú), a través de comparaciones entre los grupos que recibieron la vacuna y los que recibieron placebo. Esto sucede “en el entorno ideal de un ensayo controlado”, detalla el especialista.
El porcentaje de eficacia es empleado para solicitar aprobaciones de emergencia. Así, para la Covid-19, instituciones como la Organización Mundial de la Salud (OMS) y la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) exigen que las vacunas tengan una eficacia superior al 50% para ser aprobadas.
¿Cómo se evalúa la eficacia de una vacuna?
Los actuales ensayos clínicos de vacunas se realizan dividiendo a los voluntarios en dos grupos: unos reciben la candidata en evaluación (grupo experimental) y otros el placebo. Esta última es una sustancia idéntica en apariencia, pero sin propiedades contra la enfermedad; y se utiliza para reducir la posibilidad de sesgos. Es decir, que se sobreestime o subestime el efecto de la vacuna.
Cuando se reporta un determinado número de casos de la enfermedad entre los voluntarios, se evalúan los datos. En el caso del ensayo clínico de Sinopharm, su protocolo considera un análisis provisional de datos cuando se alcancen 150 casos, y uno final con 200. Después, los analistas identifican dentro de este grupo quienes fueron los que recibieron la vacuna o el placebo.
Con esta información, se aplica una fórmula matemática para determinar la eficacia. Esta es igual a 1 menos, la densidad de incidencia en el grupo experimental entre la densidad de incidencia en el grupo de placebos, multiplicado por 100%.
La incidencia, por su parte, se calcula dividiendo el número de casos de Covid-19 registrados en un determinado grupo, entre el total de individuos del mismo.
El investigador Mezones-Holguín sostiene que este porcentaje resultante expresa la reducción de riesgo relativo. Es decir, si una vacuna tiene una eficacia del 90%, no se puede concluir que 9 de cada 10 personas vacunadas no van a enfermarse, sino que la población vacunada tendrá un 90% más de probabilidades de no enfermarse, en comparación a los que recibieron placebos.

Ilustración: Claudia Calderón
¿Qué representa el porcentaje de eficacia?
Un artículo publicado en la revista de Lancet explica este aspecto. “Si vacunamos a una población de 100 mil y protegieramos al 95%, eso dejaría a 5 mil personas enfermas (...) Más bien, una eficacia del 95% significa que en lugar de 1.000 casos de Covid-19 en una población de 100 mil no vacunados, esperaríamos 50 casos [en la misma población pero vacunada]”.
Juan More Bayona, inmunólogo e investigador de la Universidad Nacional Mayor de San Marcos (UNMSM), precisa que, para hacer este cálculo, se debe tener en cuenta cuál es el objetivo de cada ensayo clínico. “Las vacunas [contra la Covid-19] de esta generación no han sido desarrolladas para prevenir la infección, sino la enfermedad. Es decir, si se está vacunado, se reducirá el riesgo de hospitalización y muerte”, dijo a OjoPúblico.
En otras palabras, como ya hemos explicado en artículos previos, una persona vacunada podría infectarse e incluso eventualmente transmitir el virus, aunque no desarrolle los síntomas más graves de la enfermedad ni requiera hospitalización. Por eso, los vacunados deben seguir usando mascarillas y cumpliendo las medidas de prevención.
¿Cuál es la diferencia entre una infección y una enfermedad?
El inmunólogo More Bayona explica que una persona infectada es aquella que contrae el virus Sars-Cov-2, pero no desarrolla síntomas. No obstante, puede contagiar y también puede dar positivo en una prueba molecular (PCR). Por otro lado, la enfermedad se presenta con síntomas clínicos, que van desde un dolor de garganta o fiebre, hasta mayores complicaciones.
La distinción anterior cobra aún mayor relevancia cuando se trata de ensayos clínicos. Por ejemplo, si el objetivo del ensayo es prevenir la enfermedad, para hacer el cálculo de eficacia se debe considerar solo a los voluntarios que presentaron síntomas. “Eso lo realiza el comité de datos. Son muchos factores a analizar para asignar [cada caso] como Covid-19 o no Covid-19”, detalla More Bayona.
Precisamente, este es el objetivo en el caso de la vacuna de Sinopharm, según explicó Coralith García Apac, investigadora que ha reemplazado a Germán Málaga en la dirección de la investigación, tras el caso de las “Vacunas Secretas”. “Los ensayos clínicos que se han realizado son para evaluar la eficacia [de la vacuna] en enfermedad sintomática. Para cada voluntario con PCR positivo armamos un expediente y [para determinar si se trata de Covid-19] tiene que ser evaluado por especialistas externos al grupo de investigación (César Cárcamo, Carlos Seas Ramos y Javier Lama Valdivia)”, dijo ante la Comisión Covid-19 del Congreso.
Por lo tanto, precisó, los datos difundidos en el informe preliminar presentado por Bustamante no reflejan la efectividad (protección del antígeno en condiciones reales) ni la eficacia, pues los porcentajes de dicho monitoreo consideran a todos los voluntarios que dieron positivo a una prueba PCR, realizadas de manera constante como parte del seguimiento. “No está disgregado”, indicó García Apac.
Esta posición también fue respaldada por Eduardo Ticona, investigador principal de la sede del ensayo en la Universidad Nacional Mayor de San Marcos. “Estos resultados no nos permiten analizar la eficacia de la vacuna”, advirtió ante la misma comisión.
Como se recuerda, los resultados del ensayo clínico de la fase 1 y 2 de la vacuna de Sinopharm en China publicados en The Journal of the American Association arrojaron un 79% de eficacia en la prevención de síntomas graves de la enfermedad.
¿Qué sugiere el informe preliminar difundido?
Según la investigadora Coralith García Apac, a pesar de que el informe preliminar no permite conocer el porcentaje de eficacia de la vacuna a la hora de prevenir la enfermedad, sí permite una “aproximación” a otros aspectos evaluados en el ensayo clínico, como la reducción del riesgo de hospitalización, necesidad de oxígeno, o muerte.
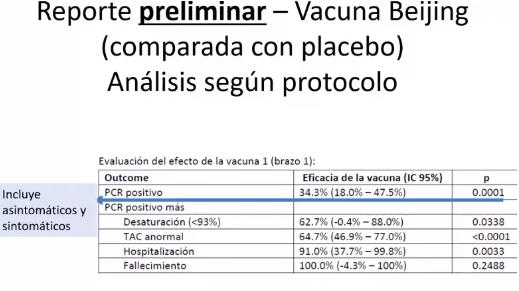
Conclusiones del reporte preliminar presentado por la investigadora Coralith García ante la Comisión Covid-19 del Congreso.
Imagen: Captura
“Si un paciente recibió la vacuna de Beijing tiene un 62,7% menos probabilidad de desaturar por debajo de 93%, cuando se le compara con alguien que ha recibido placebo. También tiene un 91% menos probabilidad de haber sido hospitalizado, lo cual es un criterio de gravedad”, dijo la epidemióloga ante al Congreso. Es decir, la persona que recibió la vacuna tiene menos posibilidad de desarrollar síntomas graves.
Asimismo, la investigadora señaló que los resultados preliminares anticipan que los resultados obtenidos con la vacuna de la cepa Beijing fueron “mejores que los obtenidos con la cepa de Wuhan”. Sin embargo, García Apac explicó que, al tratarse de un reporte preliminar, el documento era confidencial y, por otro lado, está incompleto, pues se basó solamente en 7.500 voluntarios de la sede de investigación de la Universidad Cayetano Heredia.
El investigador Edward Mezones-Holguín, coincide en que el análisis realizado el viernes pasado por el vocero del partido Fuerza Popular es impreciso y parcial, pues no se puede obtener conclusiones a partir de esos documentos.
Por su parte, Juan More advirtió que las interpretaciones erróneas pueden perjudicar el actual proceso de vacunación. “No solo se afecta la credibilidad del ensayo clínico, sino de las vacunas en general”, dijo a OjoPúblico.
¿Qué resultados conocemos sobre los ensayos clínicos de Sinopharm en otros países?
La farmacéutica estatal china Sinopharm desarrolló dos vacunas inactivadas junto a los Institutos de Productos Biológicos de Beijing y de Wuhan, que empezaron a ser evaluadas en China, en abril de 2020, a través de estudios de fase I/II; y fuera del país de origen, desde julio pasado, a través de ensayos clínicos de fase III.
En los estudios de fase I/II, el objetivo fue comprobar la seguridad y la capacidad de generar inmunidad (anticuerpos) de cada una de las vacunas; y participaron 640 voluntarios en la evaluación de la cepa Beijing, y 320 para la cepa Wuhan. Los resultados de ambas investigaciones, realizadas en China, fueron compartidas en dos de las revistas científicas más importantes a nivel mundial.
En agosto de 2020, se publicó un artículo en The Journal of the American Association(JAMA), donde se dio a conocer que el antígeno elaborado en base a la cepa de Wuhan presentó una tasa baja de reacciones adversas y demostró inmunogenicidad. Asimismo, en noviembre pasado, un artículo publicado en la revista The Lancet Infectious Diseases, informó que la vacuna inactivada de Beijing era tolerable por personas sanas y podía generar anticuerpos contra el virus.
Con el objetivo de continuar evaluando la seguridad, obtener datos sobre la eficacia y, posteriormente, conseguir una aprobación, los estudios de fase III se extendieron a Emiratos Árabes Unidos, Perú, Bahrein, Egipto, Jordania, Marruecos y Argentina. En total, más de 136 mil voluntarios se enrolaron en estos ensayos clínicos, que evaluaron en paralelo ambas cepas. En Perú, por ejemplo, la investigación se desarrolló desde setiembre con 12 mil participantes, en las universidades San Marcos y Cayetano Heredia.
En la primera semana de diciembre, el Ministerio de Salud de los Emiratos Árabes Unidos (EAU) anunció un 86% de eficacia de las dosis de Beijing, a partir de un análisis intermedio de los ensayos clínicos realizados en este país. “El análisis no muestra problemas de seguridad graves”, precisó el comunicado. Inmediatamente después, la vacuna recibió una autorización de uso de emergencia de las instituciones emiratíes.
Semanas después, el 30 de diciembre, una filial de la farmacéutica china anunció que la vacuna Beijing mostró seguridad y una eficacia del 79,34%. Además, indicó que los voluntarios que recibieron doble dosis, produjeron anticuerpos en una tasa de alrededor del 99,52%. El reporte, sin embargo, no mostró detalles sobre los participantes evaluados o la metodología del estudio y aún no ha sido publicado en revistas científicas.
Respecto a la diferencia con el porcentaje obtenido en Emiratos Árabes Unidos, representantes de Sinopharm indicaron que se debía a que cada país cuenta con sus propios estándares y procedimientos para evaluar a los pacientes, pero que ambos resultados “eran válidos”.
A pesar de esta discrepancia, la vacuna de Sinopharm consiguió una aprobación condicional del gobierno chino para su comercialización.
¿Cuáles fueron los criterios para que el Gobierno adquiriera la vacuna de Sinopharm?
El Gobierno peruano ha adquirido 1 millón de dosis de la vacuna de Sinopharm (cepa Beijing) y tiene otro acuerdo por 37 millones adicionales (por la misma cepa). Las negociaciones iniciaron a mediados de 2020, durante el gobierno de Martín Vizcarra, pero se concretaron a inicios de enero, ya en la gestión de Francisco Sagasti. Esto ocurrió luego de que el laboratorio chino diera a conocer la eficacia de 79,34% de su vacuna.
De acuerdo a la presidenta del Consejo de Ministros, Violeta Bermúdez, el Gobierno firmó un contrato con Sinopharm en base a información sobre la eficacia reportada en ensayos clínicos realizados en Emiratos Árabes Unidos. “Existen estudios internacionales de la eficacia de la vacuna que hemos adquirido”, precisó Bermúdez.
Actualmente, la vacuna de Sinopharm cuenta con una autorización sanitaria excepcional para la importación y uso -otorgada por la Dirección General de Medicamentos, Insumos y Drogas, el pasado 26 de enero de 2021-, que vence el próximo 30 de abril. No obstante, aún no cuenta con un registro sanitario condicional (RSC), figura que fue incorporada en diciembre de 2020, con la Ley 31091. “Estamos a la espera de documentación adicional [para otorgar el RSC]”, dijo hace unos días el presidente Francisco Sagasti.
 Tienes reportajes guardados
Tienes reportajes guardados