El cirujano plástico Carlos Wiegering Gonzales, un médico peruano de amplia trayectoria, consiguió que ocho mujeres de Lima aceptaran su oferta de aplicarse un producto en experimentación a cambio de la rebaja en el precio de una lipoescultura de abdomen. Era fines del 2013 cuando Wiegering empezó a citarlas en su consultorio de la Clínica Avendaño, una de las más prestigiosas del Perú. Habían sido pacientes suyas y estaban obsesionadas con recuperar los años perdidos de su juventud. El médico les contó –luego de que aceptaran el tratamiento para recibir inyecciones de un gel llamado Belle Vie (Vida Hermosa)- que esta sustancia estaba siendo probada como un magnífico regenerador de la piel. Nunca les dijo toda la verdad.
Wiegering, que estudió medicina en la Universidad Cayetano Heredia en los años 70, tampoco les advirtió a las mujeres que las dosis que luego les inyectaría en el abdomen eran parte de un experimento que no contaba con la autorización del Instituto Nacional de Salud (INS). Mucho menos les dijo que el grado de toxicidad del producto que introducía en sus cuerpos, biomaterial compuesto por células humanas, suero fetal bovino y gelatina de origen porcino, ni siquiera había sido probado en animales. Aún así, el ensayo para establecer los efectos de Belle Vie se inició en una clínica de Miraflores en abril del 2014 y se prolongó hasta febrero del 2015. Fue el primer experimento clandestino que luego sería investigado por las autoridades sanitarias del Perú.
El caso involucró a la compañía de biotecnología Cytograft Tissue Engineering, una empresa de Estados Unidos que financió el experimento ilegal en el Perú; y a los cirujanos plásticos Carlos Wiegering, quien ejerce la medicina principalmente en Miami y está acreditado hasta en siete hospitales o centros quirúrgicos norteamericanos; y Óscar Salinas Sedo, dueño de la Clínica Avendaño y cuya trayectoria incluye haber sido director de la Clínica Maison de Santé Sur y jefe del servicio de cirugía del hospital María Auxiliadora.
LÍNEA DE TIEMPO. Conoce aquí la cronología de los experimentos médicos con personas en Perú. También los graves casos de violaciones a las prácticas clínicas sancionados solo con amonestaciones entre el 2006 y el 2013.
En medio del debate nacional sobre las condiciones en las que se desarrollan los ensayos clínicos en el Perú, OjoPúblico revela un experimento ilegal que permanecería en las sombras si no fuera por el órgano de investigación del Instituto Nacional de Salud que elaboró un contundente informe en el que se detallan por lo menos nueve graves violaciones a las prácticas clínicas que pusieron en riesgo la salud de las personas reclutadas para las pruebas.
El informe elaborado por tres inspectores de la Oficina General de Investigación y Transferencia Tecnológica (Ogitt) del INS recomendó acusar a los médicos Wiegering y Salinas Sedo ante el Ministerio Público por el delito de exposición de personas al peligro y notificar al Colegio Médico del Perú por la violación de la mayoría de principios del Reglamento Nacional de Ensayos Clínicos. El actual jefe del INS, Ernesto Gozzer, ya abrió un proceso administrativo sancionador contra los dos cirujanos, pero aún no cumple con derivar el caso a la fiscalía penal y al fuero médico. El expediente está encarpetado en su despacho desde hace tres meses.
Esta es la historia.
Secretos descubiertos
El problema salió a la luz en febrero del 2015, casi un año después del inicio del ensayo ilegal en la Clínica Avendaño de Miraflores. Ese mes la Ogitt, dependencia del INS dirigida por el médico Hans Vásquez y encargada de aprobar los experimentos en seres humanos, abrió una investigación contra Wiegering, Salinas Sedo y Maribel Porth, esposa del primero y quien aceptó haber participado en el estudio que involucró a ocho pacientes mujeres.
Las pesquisas incluyeron una inspección extraordinaria de tres días en la Clínica Avendaño, que nunca estuvo acreditada como centro de investigación. Los inspectores también indagaron en los antecedentes de Cytograft, la compañía de Estados Unidos que financió el experimento ilegal, cuya infracción será notificada ante la Food and Drug Administration (FDA), la agencia que fiscaliza la industria de la salud en ese país.
VEA TAMBIÉN: Las batallas legales del monopolio farmacéutico.
En la supervisión a la Clínica Avendaño, los inspectores de la Ogitt identificaron a las mujeres que participaron en las pruebas, accedieron a sus historias clínicas y descubrieron los procedimientos ilegales. Previamente, se había ordenado la interrupción inmediata de dicho estudio. El equipo descubrió que las ocho pacientes a las que se les inyectó Belle Vie habían sido reclutadas en este centro médico y presentaban un perfil similar: edad promedio de 40 años, piel blanca, antecedentes de cirugías plásticas, y nivel socioeconómico alto.
PAREJA. El médico Carlos Weagering y su esposa, Maribel Porth, llevaron a cabo el ensayo clínico considerado ilegal. Ellos mismos lo aceptaron ante los inspectores del Instituto Nacional de Salud.
Los inspectores hallaron que las constancias firmadas por las ocho mujeres, para dar su consentimiento informado de participación en el ensayo clínico, presentaban irregularidades: los formularios estaban incompletos, carecían del sello de aprobación de un comité de ética, las páginas no estaban numeradas, tampoco consignaban la hora de suscripción de las firmas y los testigos de dicho acto no eran personas ajenas sino los mismos miembros del equipo de investigación. Peor aún, la Ogitt calificó como una falta ética la oferta hecha por Wiegering a sus pacientes para rebajar el 50% del costo total de una lipoescultura, a cambio de que aceptaran participar previamente en el estudio.
Otra infracción que verificó OjoPúblico para este reportaje es que los médicos Wiegering y Salinas Sedo nunca estuvieron acreditados como investigadores en el Registro Peruano de Ensayos Clínicos (Repec), requisito indispensable para ejercer esta actividad en el país. Tampoco la Clínica Avendaño figura en la base de datos de los centros de investigación registrados en el país. Según la Ogitt, aunque los cirujanos obtuvieron el visto bueno para este estudio del Comité de Ética en Investigación Biomédica del Hospital Dos de Mayo el 20 de marzo del 2014, nunca solicitaron la indispensable autorización del INS, la autoridad oficial en este campo.
El gel inyectado a las pacientes se llama Belle Vie (Vida Hermosa) y está hecho de células humanas, suero fetal bovino y gelatina de origen porcino
El experimento médico fue tan irregular que Belle Vie, la sustancia de las pruebas, no fue declarada en el Perú. Fue introducida en vuelos comerciales, y al interior del equipaje personal de los representantes de Cytograft que visitaron Lima, según las indagaciones de los inspectores del INS. OjoPúblico comprobó que el producto tampoco fue registrado en la Dirección General de Medicamentos Insumos y Drogas (Digemid) que debía emitir una opinión técnica sobre el perfil de seguridad del compuesto y su uso para fines exclusivos de investigación.
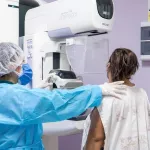
INYECTABLE. A las mujeres reclutadas se les inyectó el gel Belle Vie en el abdomen para probar los efectos en su piel.
Sin embargo, los hechos más graves descritos en el informe de los inspectores de la Ogitt ocurrieron durante el proceso mismo del experimento realizado por Wiegering y Salinas Sedo. A algunas pacientes se les inyectó la sustancia Belle Vie y a otras Juvederm, un gel que se utiliza para suavizar las líneas de expresión que se forman al sonreír o las arrugas cerca de la comisura de la boca.
El uso de esta segunda sustancia no era parte del estudio al que fueron sometidas las ocho mujeres, fue un desvío del protocolo y otra violación al Reglamento Nacional de Ensayos Clínicos, vigente desde el 2007. En la inspección también se detectó que la Clínica Avendaño -que se promociona como especializada en cirugías para perder peso- no tenía los equipos necesarios para reaccionar ante las situaciones de emergencia que se pudieran presentar durante el ensayo.
VEA TAMBIÉN: Cuidados Intensivos, la aplicación que vigilará el negocio privado de la salud.
Luego de inyectar entre cinco y diez dosis de los productos descritos a las pacientes, el estudio del cirujano Wiegering -cuya propia web lo describe como un experto en cirugía cosmética y reconstructiva- incluyó la entrega de una libreta para que las mujeres anotaran los efectos que veían en su piel. Además se les tomó muestras de sangre en forma periódica y luego de tres meses fueron preparadas para una lipoescultura en el abdomen. En esta etapa, el médico les debía extraer muestras de su piel para someterlas a biopsias en un laboratorio dispuesto por Cytograft.
El jefe del INS, Ernesto Gozzer, ya abrió un proceso contra los dos cirujanos, pero aún no cumple con derivar el caso a la fiscalía.
Cuando los inspectores entrevistaron a cuatro de las mujeres reclutadas para el estudio durante la visita a la Clínica Avendaño, se sorprendieron con sus respuestas: ninguna estaba informada sobre los riesgos del estudio y tampoco parecía importarles los efectos en su salud. En las actas de esas entrevistas figura el siguiente diálogo:
-¿Por qué aceptó participar en este ensayo clínico?
-El doctor Wiegering es de toda mi confianza. Como él estaba a cargo, no dudé en probar el producto. Si te hacían un descuento por la operación de reducción de grasa del abdomen, mucho mejor.
Pero allí no acabaron las irregularidades.
El patrocinador
Al ser el primer ensayo con Belle Vie en seres humanos, el estudio debió efectuarse en Estados Unidos, país del patrocinador del experimento, “a menos que exista una importante razón científica para hacerlo en el Perú”, indica el informe de la Ogitt elaborado después de la inspección realizada los días 19, 20 y 23 de febrero pasado.
Cytograft se ubica en California y se dedica al desarrollo de terapias médicas basadas en el uso de células para reparar tejidos y órganos enfermos. Fue creada en 1999, pero se hizo mundialmente famosa el 2007 cuando sus fundadores, los biólogos Nicolas L’Hureux y Todd McCallister, crearon los primeros vasos sanguíneos artificiales. Los resultados, destacados en su momento por la prestigiosa revista científica británica The Lancet, fueron fruto de años de ensayos con enfermos de insuficiencia renal en Argentina y Polonia. Cytograft no hace estudios en Estados Unidos.
La empresa extranjera no estaba acreditada como patrocinadora de ensayos clínicos en el Perú. Antes de este experimento, tampoco había presentado oficialmente otras solicitudes para efectuar este tipo de estudios en el país.
PATROCINADOR. La compañía Cytograft dice en su página web que hace en ensayos clínicos en Europa y Sudamérica.
En uno de los reportes de la investigación, se consigna que el representante de Cytograft, un joven biólogo estadounidense llamado David Gebhart, señaló a Oscar Salinas Sedo como representante legal de la empresa en Lima. OjoPúblico verificó que no existen documentos que sustenten esta versión. Este último también dijo a la Ogitt que no tuvo contacto con el patrocinador del estudio.
A manera de descargo, el presidente de Cytograft, Todd McAllister, envió una carta sin fecha y en inglés al Instituto Nacional de Salud para indicar que recién el 13 de febrero de 2015 -después de revelarse las irregularidades en la Clínica Avendaño- fue informado “por el Comité de Ética del Ministerio de Salud del Perú” (aunque ese órgano no existe) de que no habían presentado la documentación completa para el ensayo en Lima. Por todas estas razones, la Ogitt consideró denunciar a esta compañía ante la FDA de Estados Unidos.
-No dudé en probar el producto. Si te hacían un descuento por la operación de reducción de grasa del abdomen, mucho mejor.
Con las normas administrativas vigentes, de ser hallados responsables por el ensayo clínico ilegal, la máxima sanción para Wiegering y Salinas Sedo sería quedar impedidos de ejercer la investigación clínica en el país, pero solo temporalmente. Algo que ni les afecta, ya que tampoco tienen permiso para hacerlo. Por lo demás, podrían seguir desarrollando su práctica como cirujanos.

CONCLUSIONES: El Instituto Nacional de Salud (INS) señala directamente a Carlos Wiegering y Oscar Salinas Sedo en el informe de inspección a la clínica Avendaño. Extracto de la resolución.
El jefe del INS, Ernesto Gozzer, abrió en marzo último un procedimiento administrativo contra los médicos, pero extrañamente aun no cumple con notificar al Ministerio Público para el inicio de una investigación penal. De ser acusados por la fiscalía podrían ser sancionados por exposición de personas al peligro, delito penado hasta con cuatro años de cárcel.
Huellas delatoras
La defensa legal de los médicos acusados se basa en el desconocimiento. Wiegering señaló en una carta al INS que las graves irregularidades se debieron a un “error involuntario de comunicación y a la falta de información”. El propio Salinas Sedo declaró que desconocía las facultades del INS para supervisar los ensayos clínicos, y dijo creer que solo bastaba con la aprobación del comité de ética de algún establecimiento de salud. También la coordinadora del estudio, Maribel Porth, esposa de Wiegering, afirmó desconocer todo el proceso regulatorio sobre la autorización de ensayos clínicos en el país. Durante la investigación, los inspectores de la Ogitt recabaron documentos que desmienten estas versiones.
La prueba principal está en un documento en el que Salinas Sedo se compromete a enviar los papeles de aprobación por el INS al comité de ética del Hospital Dos de Mayo, en donde obtuvo el visto bueno inicial. Otra evidencia es el propio protocolo del estudio, que anuncia el inicio del reclutamiento de las mujeres para cuando se tuviera la aprobación de las autoridades. En el formato del consentimiento informado también se advierte a las pacientes que sus datos podían ser compartidos con las autoridades que regulan este campo. Además, los inspectores del INS recabaron un correo electrónico en que la propia Maribel Porth le cuenta a una de las pacientes que el equipo está a la espera de la aprobación del Ministerio de Salud. Todo esto, meses antes de que se conociera el caso.
El informe de inspección del caso contempla denunciar a Cytograft ante la Food and Drug Administration (FDA) de EE.UU.
PROPIETARIO. El cirujano plástico Óscar Salinas Sedo coinvestigador del ensayo ilegal y propietario de la clínica Avendaño de Miraflores.
OjoPúblico logró comunicarse por teléfono con Carlos Wiegering, quien vive en Miami, para recoger sus descargos. El médico dijo que “no hubo nada ilegal, solo un problema de falta de comunicación del ensayo clínico con el Instituto Nacional de Salud”. Además, indicó que él mismo reportó los hechos a las autoridades sanitarias para regularizar el trámite del estudio.
Según la documentación a la que accedimos, Wiegering lo hizo cerca de un año después de haber iniciado el experimento con ocho mujeres. Lo que el cirujano plástico no respondió fue cómo ingresó la sustancia Belle Vie al Perú y tampoco por qué esta no fue registrada en la Digemid. Asimismo, rechazó que los inspectores del INS detectaran una serie de irregularidades en los procedimientos del estudio realizado en la Clínica Avendaño. [Escuche AQUÍ el audio del diálogo completo].
Solicitamos también una entrevista al médico Óscar Salinas Sedo, a los representantes de Cytograft y al jefe del INS, Ernesto Gozzer, pero al cierre de edición no respondieron nuestras solicitudes. El Instituto Nacional de Salud tampoco contesta hasta la fecha un pedido de OjoPúblico para que informe si existen ensayos clínicos fuera de la ley con procesos sancionadores abiertos. La solicitud, basada en la Ley de Transparencia y Acceso a la Información Pública, fue hecha el 22 de junio pasado.
“No hubo nada ilegal, solo un problema de falta de comunicación del ensayo clínico con el Instituto Nacional de Salud”.
Carlos Wiegering, cirujano involucrado
La documentación revisada por OjoPúblico permite establecer que el caso de Belle Vie es el primer ensayo clandestino investigado por el Instituto Nacional de Salud desde el 2006, cuando se aprobaron las primeras normas para la experimentación clínica en el Perú. Entre ese año y el 2012, el INS investigó 19 casos de violaciones a las buenas prácticas clínicas que ocasionaron daños serios y muertes de participantes en estudios patrocinados por farmacéuticas y organismos de investigación extranjeros, aunque estos sí tenían autorización. Cinco de esos casos concluyeron con simples amonestaciones a los médicos involucrados. El resto quedó en el archivo. Todos los expedientes se mantuvieron en reserva hasta que uno de los autores de este reportaje reveló su contenido en una investigación periodística publicada en El Comercio en junio de 2013.
Desde entonces, el Ministerio de Salud se comprometió a aprobar un nuevo reglamento nacional de ensayos clínicos para hacer más transparente esta actividad, proteger a las personas reclutadas y sancionar en forma proporcional a los daños todas las violaciones cometidas por investigadores y patrocinadores de este tipo de estudios. Sin embargo, las observaciones de gremios involucrados como la Asociación Nacional de Laboratorios Farmacéuticos del Perú (Alafarpe) y la Asociación Peruana de Organizaciones de Investigación Clínica por Contrato (Apoicc) dilataron su aprobación.
VEA TAMBIÉN: Jefa de Susalud: Clínicas y pacientes se rigen por el libre mercado.
A mediados del 2014, el Instituto Nacional de Salud comunicó que volvería a revisar desde cero la nueva propuesta legal y el trámite quedó en el limbo. Pero el problema retornó a la agenda ministerial el 19 de junio pasado, tras un informe de La República sobre experimentos clínicos con niños, que obligó al ministro de Salud, Aníbal Fernández, a suspender todos los estudios en menores de edad y en pueblos indígenas como una medida preventiva hasta que sea aprobada la nueva legislación.
“El reglamento será más riguroso para proteger los derechos de las personas”, dijo el ministro. Queda claro que el destino del desconocido caso del experimento ilegal en la clínica Avendaño de Miraflores también será una prueba de fuego para medir ese compromiso.
 Tienes reportajes guardados
Tienes reportajes guardados