El Ministerio Público y el Colegio Médico del Perú investigarán el ensayo clínico con ocho mujeres realizado por los médicos Carlos Wiegering y Óscar Salinas Sedo en la Clínica Avendaño de Miraflores entre abril del 2014 y febrero de 2015 sin autorización de las autoridades sanitarias, informaron a OjoPúblico voceros del Instituto Nacional de Salud (INS), organismo regulador de los experimentos médicos con seres humanos en el Perú.
El estudio, patrocinado por la compañía estadounidense Cytograf Tissue Engineering, se hizo para probar los efectos de un gel inyectable para la piel denominado Belle Vie, que se encontraba en la primera fase de investigación. Al enviar su informe a las instancias penales y administrativas correspondientes, el INS ratificó la ausencia de autorización del ensayo clínico y las infracciones cometidas por los dos cirujanos involucrados.
La documentación del expediente Belle Vie fue derivada a la fiscalía penal de turno y a la Comisión de Ética y Deontología del Colegio Médico del Perú por el jefe de la Oficina General de Investigación y Transferencia Tecnológica (OGITT), Hans Vásquez, el pasado siete de julio. Esto ocurrió el mismo día en que OjoPúblico solicitó una entrevista a su superior, el jefe del INS, Ernesto Gozzer, para el reportaje “Belle Vie: el primer experimento clandestino investigado en el Perú”. El funcionario no accedió a la entrevista, pero inmediatamente después de la publicación del informe sus voceros indicaron que "el caso no estaba encarpetado en su despacho".
Sin embargo, el informe del órgano fiscalizador del INS se registró como ingresado al Ministerio Público y Colegio Médico recién el pasado 10 de julio, según las fechas de cargo de los documentos. En una carta notarial enviada ayer, Gozzer dijo que el proceso sancionador es responsabilidad de la OGITT y no de su jefatura.
CARTA. El jefe del INS, Ernesto Gozzer, aclara en su misiva que el caso Belle Vie está en manos del órgano fiscalizador de su institución y no de su despacho.
El caso también ha sido acogido por el Congreso. El legislador Jaime Delgado, miembro de la Comisión de Defensa del Consumidor y Organismos Reguladores de los Servicios Públicos, solicitó al ministro de Salud, Aníbal Velásquez, un balance completo sobre el número de ensayos clínicos autorizados que se realizan en establecimientos públicos y privados del país, así como de las acciones de vigilancia que desarrolla el INS y las medidas adoptadas frente a los casos de experimentos médicos ilegales.
REGLAMENTO EN CONSULTA
El reportaje de OjoPúblico y los informes del diario la República sobre las graves irregularidades cometidas durante la ejecución de estudios médicos experimentales en el país obligaron también al Ministerio de Salud a poner en consulta pública esta semana el proyecto del nuevo Reglamento Nacional de Ensayos Clínicos que establece las condiciones para el enrolamiento de personas en experimentos médicos. La medida se oficionalizó mediante la resolución publicada el 15 de julio pasado en el boletín de normas legales del diario El Peruano.
Sin embargo, en una primera revisión, este medio advierte que existen omisiones importantes en la norma que se pretende aprobar. La disposición no contempla el régimen de sanciones por violaciones a las buenas prácticas clínicas discutido entre los años 2013 y 2014. Además, se ha descartado el acceso futuro a la medicación para aquellos pacientes con enfermedades crónicas (VIH, cáncer y diabetes) que prueban productos en investigación de empresas farmacéuticas. Actualmente, ocurre que una vez que concluyen los estudios clínicos, los laboratorios dejan de proporcionar el producto en evaluación a los enfermos captados para las pruebas y les piden esperar a que salga al mercado para poder comprarlo.

DISCUSIÓN. El proyecto del nuevo Reglamento Nacional de Ensayos Clínicos no contempla garantizar el acceso futuro al tratamiento para aquellas personas que ayudan a probar la eficacia de un medicamento. Crédito: OjoPúblico.
RESPUESTA A CARTA NOTARIAL
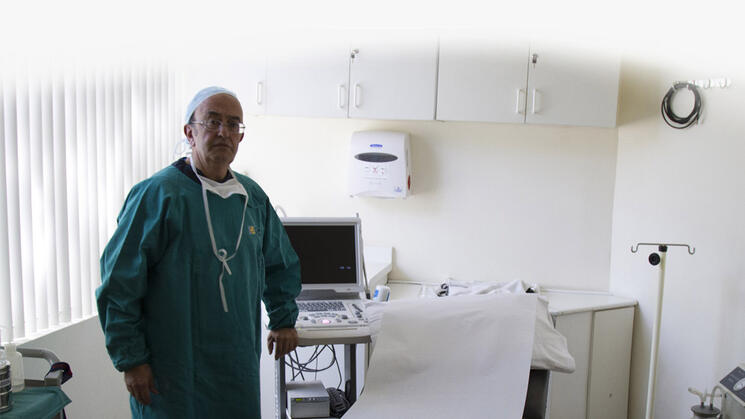
OjoPúblico entrevistó también al cirujano Óscar Salinas Sedó, propietario de la Clínica Avendaño y coinvestigador del ensayo clínico con el producto Belle Vie, quien negó estar involucrado en un ensayo clínico realizado fuera de la ley. El médico dijo que el estudio con dicha sustancia contó con la opinión favorable del Comité de Ética en Investigación Biomédica del Hospital Nacional Dos de Mayo y fue detalladamente informado a las ocho mujeres que participaron en el experimento médico. Asimismo, Salinas Sedo reveló que su colega Carlos Wiegering, quien reside en Miami y participó como investigador principal del estudio, se encargó de traer el gel inyectable Belle Vie en sus viajes a Lima y reconoció que la sustancia no fue declarada en la Dirección General de Medicamentos Insumos y Drogas.
Aquí el audio completo de la entrevista realizada en la sede de la clínica Avendaño:
VERSIÓN. El médico Óscar Salinas Sedó brindó su versión a OjoPúblico. En todo momento negó haber participado en un experimento sin autorización, como dice el INS. Crédito: Midchel Meza.
Con estos mismos argumentos, el médico Carlos Wiegering envió una carta notarial a OjoPúblico en la que rechazó formar parte de un ensayo clínico ilegal y aseguró que solo hubo un problema de comunicación con el Instituto Nacional de Salud. “Fuimos nosotros quienes informamos al INS y suspendimos el ensayo clínico al momento de entregar el informe de avance (dentro de los seis meses) al Comité de Ética en Investigación Biomédica del Ministerio de Salud – Hospital Nacional Dos de Mayo (23 de enero del 2015), quienes recién nos comunican que debemos pedir además la autorización al INS, ya que esta instancia aún no tenía conocimiento de este ensayo clínico”, sostiene en su carta.
Sin embargo, para la autorización de un ensayo clínico en el Perú, el patrocinador del estudio o los investigadores contratados deben presentar al Instituto Nacional de Salud (INS) un expediente con 13 requisitos para su evaluación. Entre ellos está el certificado del establecimiento en donde se desarrollará el experimento médico acreditado como centro de investigación, los formularios de consentimiento informado debidamente redactados, las declaraciones juradas de compensación y pólizas de seguro para los voluntarios reclutados y la aprobación del protocolo del experimento por un comité de ética en investigación registrado en el país.
RECHAZA ACUSACIÓN. Esta es la carta notarial enviada por el médico Carlos Wiegering a OjoPúblico el 15 de julio pasado.
Solo este último requerimiento tenía el estudio del producto Belle Vie y no existe expediente de que en algún momento los médicos Wiegering y Salinas, junto a Cytograft, hubieran realizado el trámite de autorización en el INS. OjoPúblico difundió esta investigación por ser de interés público -en pleno debate del sector Salud sobre el tema- y rechaza haber tenido interés alguno en desprestigiar a los cirujanos antes citados.
 Tienes reportajes guardados
Tienes reportajes guardados